 更多“某温度时,反应,则反应HBr(g)等于()”相关的问题
更多“某温度时,反应,则反应HBr(g)等于()”相关的问题
A.①②
B.①③
C.③④
D.②③
某温度下反应2NO(g)+O2(g)===2NO2(g)的速率常数k=8.8×10-2mol-2.dm6.s-1,已知反应对O2来说是一级反应,则对NO为________________级反应,反应的速率方程为________________;当反应物浓度均为0.05 mol.dm-3时,反应的速率是________________。
A.容器内颜色不随时间变化
B.容器内H2、Br2、HBr的浓度之比为1:1:2
C.容器内压强不随时间变化
D.单位时间内消耗n mol H2,同时生成2n mol HBr
A.等于5s
B.等于10s
C.大于10s
D.小于10s
问题1、1840年Devil用干燥的氧气通过干燥的硝酸银,得到N2O5,该反应的氧化产物是一种参与大气循环的气体,写出该反应的化学方程式()。
问题2、F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应
2N205(g)→4NO2(g)+O2(g)+Q1(Q1<0),2NO2(g) N204(g)+Q2(Q2>0)
N204(g)+Q2(Q2>0)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强P随时间t的变化如下表所示(t=00时,N2O5(g)完全分解);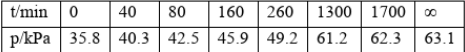
①究表明,N2O5(g)分解的速率v=2x10-3Xpn2o5(kPa'min)。t=62min时,测得体系Po2=2.9kPa,则此时PN2O5:=()kPa,v=()(kPa/min)。
②若提高反应温度至35℃,则N2O5(g)完全分解后体系压强P00(35℃)()63.1kPa(填“大于”、“等于”或“小于”),试从勒夏特列原理的角度加以解释()。
③写岀N2O4(g) 2NO2(g)反应的平衡常数表达式()。
2NO2(g)反应的平衡常数表达式()。
问题3、对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步:N2O5 NO2+NO3快速平衡
NO2+NO3快速平衡
第二步NO2+NO3→NO+NO2+O2慢反应
第三步NO+NO3→2NO2快反应
其中可近似认为第二步反应不影响第一步的平渐。下列表述错误的是()(填编号),
A.v(第一步反应的逆反应)>v(第二步反应)B.反应的中间产物只有NO3
C、该反应的速率主要由第二步决定D.N2O5的分解率主要由第一步决定
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C2H5Br
C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60℃,可缩短反应达到平衡的时间
已知反应:mA(g)+nB(g)=pC(g)+qD(g),当压缩体积使体系总压力增大一倍时,该反应的反应速率增大到原来的4倍,则(m+n)等于( )。
(A) 1 (B) 2 (C) 4 (D) 0
A.等于p%
B.大于p%
C.小于p%
D.无法判断
某温度时将2.00mol PCl5与1.00mol PCl3相混合,发生反应
PCl5(g ) = PCl3(g ) + Cl2(g )
平衡时总压为202kPa,PCl5(g)转化率为91%。求该温度下反应的平衡常数Kp和Kθ。



 如果结果不匹配,请
如果结果不匹配,请 

















