 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知反应:mA(g)+nB(g)=pC(g)+qD(g),当压缩体积使体系总压力增大一倍时,该反应的反应速率增大到原来的4倍,则
已知反应:mA(g)+nB(g)=pC(g)+qD(g),当压缩体积使体系总压力增大一倍时,该反应的反应速率增大到原来的4倍,则(m+n)等于( )。
(A) 1 (B) 2 (C) 4 (D) 0
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知反应:mA(g)+nB(g)=pC(g)+qD(g),当压缩体积使体系总压力增大一倍时,该反应的反应速率增大到原来的4倍,则(m+n)等于( )。
(A) 1 (B) 2 (C) 4 (D) 0
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知反应:mA(g)+nB(g)=pC(g)+qD(g),当…”相关的问题
更多“已知反应:mA(g)+nB(g)=pC(g)+qD(g),当…”相关的问题
A.③、④、⑤、⑥
B.②、③、④、⑥
C.①、③、④、⑤
D.①、③、④、⑥
在mA(气)+nB(气) pC(气)+qD(气)平衡体系中,升高温度,平衡向右移动,则正反应是______反应;若减小压强,平衡向右移动,则”m、n、p、q之间的关系为______;若增大压强,平衡不移动,则m、n、p、q之间的关系为______。
pC(气)+qD(气)平衡体系中,升高温度,平衡向右移动,则正反应是______反应;若减小压强,平衡向右移动,则”m、n、p、q之间的关系为______;若增大压强,平衡不移动,则m、n、p、q之间的关系为______。
A.K越大,达到平衡时,反应进行的程度越大
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度的改变而改变
D.K随温度和压强的改变而改变
某基元反应2A(g)+B(g)=C(g)+D(g)的初始分压PA=81.04 kPa,PB=60.78 kPa。当反应至PC=20.2 kPa时,反应速率大约是初始速率的
A.1/6 8.1/16 C.1/24 D.1/48
已知反应CH3CHO(g)→CH4(g)+CO(g)的活化能Ea=188.3kJ·mol-1;如果以碘蒸气为催化剂,反应的活化能E'a=138.1kJ·mol-1。计算温度为800K时,加碘催化剂,反应速率增大为原来的多少倍。
已知NO(g)和NO2(g)的

(A) 33.2kJ·mol-1(B) 57.1kJ·mol-1
(C) 123.5kJ·mol-1(D) 90.3kJ·mol-1
已知下列两个反应:
(1)2H2(g)+O2(g)=2H2O(1);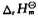 (298K)=-571.70kJ·mol-1
(298K)=-571.70kJ·mol-1
(2)2H2(g)+O2(g)=2H2O(g);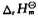 (298K)=-483.65kJ· mol-1
(298K)=-483.65kJ· mol-1
求298K时水的标准摩尔汽化热。
A.16 g
B.20 g
C.24 g
D.32 g
 则反应开始前p总=(),反应进行的方向是().
则反应开始前p总=(),反应进行的方向是().
A.△H是CO2(g)的生成热
B.△H是CO(g)的燃烧热
C.△H<0
D.△H=△U