 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
下列反应在298K时的平衡常数为( )。
A.lg

B.lg

C.lg

D.lg

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)

A.lg

B.lg

C.lg

D.lg

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“下列反应在298K时的平衡常数为()。 A.lg=3/0.0…”相关的问题
更多“下列反应在298K时的平衡常数为()。 A.lg=3/0.0…”相关的问题
反应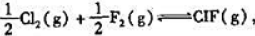 在298K和398K下,测得其标准平衡常数分别为9.3x109和3.3x109.
在298K和398K下,测得其标准平衡常数分别为9.3x109和3.3x109.
(1) 计算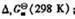
(2)若298~398K范围内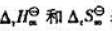 基本不变,计算
基本不变,计算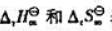
A.电对Fe3+/Fe2+做正极
B.反应Fe+2Fe3+=3Fe2+的平衡常数大约为8×1040
C.电池组成式为(-)Fe|Fe2+(c1)||Fe2+(c2),Fe3+(c3)|Pt()
D.电池的标准电动势为0.331V
已知下列元素电势图:
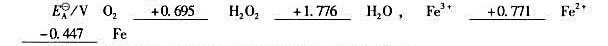
①H202能否发生歧化反应?如果能发生,写出反应式。
②在pH=3的条件下,判断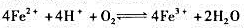 进行的方向。(设其他各离子浓度为1.0mol/L)。
进行的方向。(设其他各离子浓度为1.0mol/L)。
③计算298K时,反应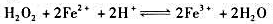 的平衡常数。(用
的平衡常数。(用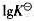 表示)
表示)
298K时,已知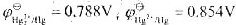 ,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
已知在298K时,下列反应:
①CO2(g)+2NH3(g)===H2O(g)+CO(NH2)2(s),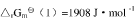
②
③C(石墨)+O2(g)===CO2(g),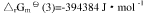
④N2(g)+3H2(g)===2NH3(g),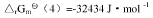 试求:(1)尿素CO(NH2)2(s)的标准摩尔生成Gibbs自由能
试求:(1)尿素CO(NH2)2(s)的标准摩尔生成Gibbs自由能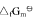 ;(2)由稳定单质生成尿素反应的平衡常数与上列反应平衡常数的关系式;(3)由单质生成尿素反应的平衡常数
;(2)由稳定单质生成尿素反应的平衡常数与上列反应平衡常数的关系式;(3)由单质生成尿素反应的平衡常数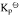 。
。
反应C2H5I+OH-====C2H5OH+I-,在298K时的k=5.03×10-2mol·L-1·s-1,在333K时的k=6.71mol·L-1·s-1。计算反应在305K时的速率常数。
A.△rH>0△rS>0
B.△rH>0△rS<0
C.△rH<0△rS<0
D.△rH>0△rS>0