 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
当T为298K时,反应2NaO(g)→2Na(g)+O2(g);ΔH=-164.1kJ·mol-1,B=240kJ·mol-1.该反应被Cl2催化,催化反应的Ea=140kJ·mol-1.催化后反应速提高了多少倍?催化反应的逆反应活化能是多少?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“当T为298K时,反应2NaO(g)→2Na(g)+O2(g…”相关的问题
更多“当T为298K时,反应2NaO(g)→2Na(g)+O2(g…”相关的问题
工业生产SO2Cl2(1)有以下两种方法:
SO2(g)+C(g)=SO2Cl2(1)①
SO2(g)+2HCl(g)=SO2Cl2(1)+H2O(1)②
(1)请根据热力学数据计算说明,欲得到更大的转化率,应采用什么路线更好?
(2)对于②反应,增大体系温度,对反应有什么影响?
(3)求反应①在298K时的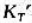
2NO2(g).25℃下该反应的初始速率实验数据如表3-1:

(1)写出反应速率方程;
(2)计算25℃时反应速度系数k;
(3)co(NO)=0.0030mol·L-2,co(O2)=0.0015rmol·L-2时,相应的初始速半为多少?
1000K时,反应C(s)+2H2(g) CH4(g)的A,Gf=19290/mol.现有与碳反应的气体,其中含有CH.(g)10%,H2(g)80%,N2(g)10%(体积%)。试问:
CH4(g)的A,Gf=19290/mol.现有与碳反应的气体,其中含有CH.(g)10%,H2(g)80%,N2(g)10%(体积%)。试问:
(1)T=1000K,p=100kPa时,甲烷能否形成?
(2)在(1)的条件下,压力需增加到多少。上述合成甲烷的反应才可能进行?
蔗糖水解反应
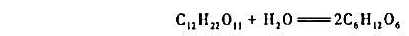
活化能Ea=110kJ·mol-1;298K是其半衰期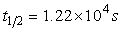 ,且
,且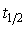 与反应物浓度无关。
与反应物浓度无关。
(1)求此反应的反应级数;
(2)写出气速率方程;
(3)求308K时的速率常数k。
应
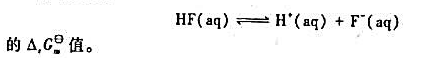
根据298.15K,pΘ时物质的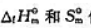 值,(1)求下列反应CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)的
值,(1)求下列反应CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)的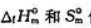 ;(2)计算上述反应在298.15K及pΘ下的ΔrGΘm值,.并判断由CO2(g)和NH3(g)反应生成尿素是否为自发过程.
;(2)计算上述反应在298.15K及pΘ下的ΔrGΘm值,.并判断由CO2(g)和NH3(g)反应生成尿素是否为自发过程.
某抗菌素A注入人体后,在血液中呈现简单的级数反应,如果在人体中注射 0.5 g 该抗菌素,然后在不同时间 t 测定它在血液中的浓度 cA(以 表示),得到下面的数据:
表示),得到下面的数据: (1)确定反应级数 (2)计算反应速率系数 (3)求半衰期 (4)若要使血液中抗菌素浓度不低于0.37mg/2500px3,问几小时后注射第二针?
(1)确定反应级数 (2)计算反应速率系数 (3)求半衰期 (4)若要使血液中抗菌素浓度不低于0.37mg/2500px3,问几小时后注射第二针?
A.电对Fe3+/Fe2+做正极
B.反应Fe+2Fe3+=3Fe2+的平衡常数大约为8×1040
C.电池组成式为(-)Fe|Fe2+(c1)||Fe2+(c2),Fe3+(c3)|Pt()
D.电池的标准电动势为0.331V