 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
根据下列配离子的空间构型,画出它们形成时中心离子的价层电子分布,并指出它们以何种杂化轨道成
(1)/[CuCl2/]-(直线形);
(2)/[Zn(NH3)4/]2+(四面体形);
(3)/[Co(NCS)4/]2-(四面体形).
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
(1)/[CuCl2/]-(直线形);
(2)/[Zn(NH3)4/]2+(四面体形);
(3)/[Co(NCS)4/]2-(四面体形).
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“根据下列配离子的空间构型,画出它们形成时中心离子的价层电子分…”相关的问题
更多“根据下列配离子的空间构型,画出它们形成时中心离子的价层电子分…”相关的问题
试用价层电子对互斥理论判断下列分子或离子的空间构型,再用杂化轨道理论说明它们的成键情况。
(1)SF3; (2)BeF3; (3)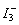 ; (4)
; (4)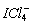 ;
;
已知配离子[CoCl 2 (en) 2 ] + 的磁矩为零,则配离子的空间构型为________。该配离子的中心离子 d 轨道分裂能比电子成对能________,d 电子的排布方式为___________。
已知[Co(NH3)6]3+的μ=0,则C03+杂化轨道的类型是(9) ,配离子的空间构型是 (10) 。
内轨型配离子[Cu(CN)4]2-磁矩为2.0 B.M.,则其空间构型和中心原子杂化轨道类型为()。
A.四面体和sp3杂化
B.正方形和dsp2杂化
C.正八面体和sp3d2杂化
D.正八面体和d2sp3杂化
(2)从书中查出上述各碳酸盐的分解温度(CdCO3为345℃),与计算结果加以比较,并加以评价.
(3)各碳酸盐分解温度的实验值与由计算结果所得出的有关碳酸盐的分解温度的规律是否一致?并从离子半径、离子电荷、离子的电子构型等因素对上述规律加以说明.
(3)分解温度的实际值和计算值的规律是一致的.金属离子的半径越小,离子所带的电荷数越大,极化能力就越强,相应碳酸盐分解温度越低;金属离子电子构型为18e的极化能力比8e的强;而极化越大,相应的碳酸盐越易分解.
A.原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的
B.只有能量相近的原子轨道才能发生杂化
C.一定数目的原子轨道杂化后,可以得到更多数量的杂化轨道
D.CH4分子中有四个能量相等的C—H键,键角为109°28′,分子的空间构型为正四面体,这一情况可以用杂化轨道理论解释