 更多“用两羧酸钠的混合溶液进行上述电解反应,会生成几种不同的烷烃?”相关的问题
更多“用两羧酸钠的混合溶液进行上述电解反应,会生成几种不同的烷烃?”相关的问题
A.原混合溶液中钾离子浓度为2mol/L
B.上述电解过程中共转移6mol电子
C.电解得到的铜的物质的量为0.5mol
D.电解后溶液中氢离子浓度为2mol/L
50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题: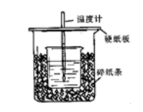 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会();用50ml0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会()均。填“偏大”“偏小”“无影响”。
用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会();用50ml0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会()均。填“偏大”“偏小”“无影响”。
电解工作原理的实际应用非常广泛。
(1)请画出铜棒镀银的简易装置设计图()。(实验可选用品:铜棒,银片,石墨棒,硫酸铜溶液,硝酸银溶液,导线,电源,烧杯)。
(2)工业上为了处理含有Cr2O12-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是()(填字母)。
A、阳极反应:Fe-2e-=Fe2+
B、阴极反应:2H++2e-=H2↑
C、在电解过程中工业废水由酸性变为碱性
D、可以将铁电极改为石墨电极
(3)某同学设计了如图装置进行以下电化学实验。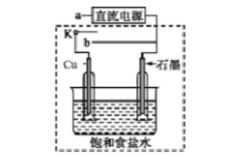 ①当开关K与a连接时,两极均有气泡产生,则阴极为()电极。
①当开关K与a连接时,两极均有气泡产生,则阴极为()电极。
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为()。请写出此时Cu电极上的电极反应()。
(4)某溶液中含有的离子如下表: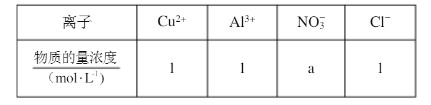 用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是()(填字母)。
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是()(填字母)。
A、电解后溶液呈酸性
B、a=3
C、阳极生成1.5molCl2
D、阴极析出的金属是铜与铝
A.FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B.用惰性电极电解含有H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子
C.反应A(g)B(g)△H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-Ea-Eb)kJ/mol
D.3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
移取20.00mL HCOOH和HAc的混合溶液,以0.1000mol·L-1NaOH溶液滴定至终点时,共消耗25.00mL。另取上述溶液20.00mL,准确加入0.02500mol·L-1KMnO4强碱性溶液50.00mL,使其反应完全后,调至酸性,加入0.20000mol·L-1Fe2+标准溶液40.00mL,将剩余的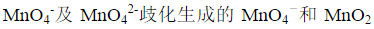 全部还原至Mn2+,剩余的Fe2+溶液用上述KMnO4标准溶液滴定,至终点时消耗24.00mL。计算试液中HCOOH和HAc的浓度。
全部还原至Mn2+,剩余的Fe2+溶液用上述KMnO4标准溶液滴定,至终点时消耗24.00mL。计算试液中HCOOH和HAc的浓度。
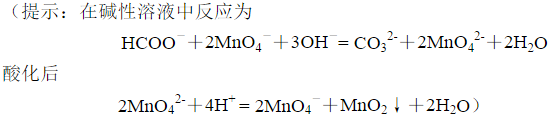
海洋中蕴含丰富的资源,下图涉及多个以海水为原料的生产流程。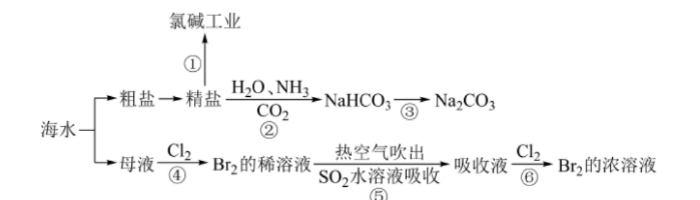 完成下列填空:
完成下列填空:
(1) 步骤①中电解饱和食盐水的化学方程式是()。
(2)工业上用Cl2与KOH(热溶液)制备KClO3,,Cl2+KOH=KCl+KClO3+H2O。配平上述反应方程式,并标出电子转移方向和数目()。
(3)关于卤素的下列说法错误的是()。
A、单质的熔点:Cl2>Br2>I2
B、元素的非金属性:Cl>Br>I
C、单质的氧化性:I2>Br2>Cl2
D、从海洋中获得Cl2,Br2的过程均涉及氧化还原反应
(4)对图中所示生产过程的说法正确的是()。
A、溶解度:NaHCO3>Na2CO3
B、第④⑤⑥步骤中,溴元素均被还原
C、第⑤⑥步骤的目的是进行溴的富集,提高Br2的浓度
D、联碱法与氨碱法相比,NaCl利用率较高,且能耗低
(5)步骤②是在饱和食盐水中先通入NH3再通入CO2,原因是()。
(6)某同学将CO2通入NaOH溶液中,当溶液呈中性时,溶液中浓度最大的微粒是()。
A、c(Na+)B、c(CO32-)C、c(HCO3-)D、c(H+)
A.2Cu2++2H2O=====电解2Cu+4H++O2↑
B.u2++2Cl-=====电解Cu+Cl2↑
C.2Cl-+2H2O=====电解2OH-+H2↑+Cl2↑
D.2H2O=====电解2H2↑+O2↑
A.铁粉溶于稀硫酸:2Fe+6H+=== 2Fe3++3H2↑
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO 3-== CaCO3↓+H2O
C.用惰性电极电解 MgCl2 溶液: 2Cl-+2H2O 电解Cl2↑+H2↑+2OH-
D.室温下,氯化铵溶液 pH<7 的原因:NH ++H2O == NH3•H2O+H+
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为
D.硫酸根离子在电解过程中向阳极移动


 如果结果不匹配,请
如果结果不匹配,请 

















