 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
用Pt电极电解一定浓度的CuSO4溶液,试分析阴极部、中部和阳极部溶液的颜色在电解过程中有何变化?若都改用Cu电极,三部溶液颜色变化又将如何?
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用Pt电极电解一定浓度的CuSO4溶液,试分析阴极部、中部和…”相关的问题
更多“用Pt电极电解一定浓度的CuSO4溶液,试分析阴极部、中部和…”相关的问题
A.相等
B.前者大于后者
C.后者大于前者
D.无法确定
Na2Cr207+H2S04溶液在使用后6价铬被还原为3价铬,把此废液电解,使3价铬被氧化为6价铬。现有含260g·L-1Cr2(SO4)3+20g·L-1Na2Cr207+250g·L-1H2SO4废液,用电解法再生到90%的铬以6价态存在为止。设两电极的电流效率为l00%,电解过程中硫酸浓度变化很小。试分别计算电解开始和终止时所需槽电压的理论值,并计算再生液的最终组成。在计算中可用浓度代替活度。
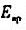 =0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。
=0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。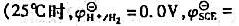
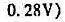
下列电池Pt Sn4+,Sn2+溶液II标准甘汞电极30℃时,测得E=0.07V.计算溶液中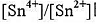 比值(忽略液接电位).
比值(忽略液接电位).
A.电极电位随溶液浓度变化而变化
B.电极通过的电流随溶液浓度变化而变化
C.电极电阻随溶液浓度变化而变化
D.电极电位恒定,不随溶液浓度而变化