 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
在298.15K,C3H6(g)+H2(g)--->C3H8(g),△rHmƟ=-123.9KJ/mol,丙烷的恒容燃烧热Qv=-2213kJ/mol,已知△rHmƟco2=-393.5kJ/mol,△rHmƟH2O(l)=-286kJ/mol,求△cHmƟ(丙烯)=kJ/mol(保留一位小数)
在298.15K,C3H6(g)+H2(g)--->C3H8(g),△rHmƟ=-123.9KJ/mol,丙烷的恒容燃烧热Qv=-2213kJ/mol,已知△rHmƟco2=-393.5kJ/mol,△rHmƟH2O(l)=-286kJ/mol,求△cHmƟ(丙烯)=kJ/mol(保留一位小数)
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“在298.15K,C3H6(g)+H2(g)--->C3H8…”相关的问题
更多“在298.15K,C3H6(g)+H2(g)--->C3H8…”相关的问题
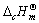 =-2058.0kJ·mol-1,试求恒容反应
=-2058.0kJ·mol-1,试求恒容反应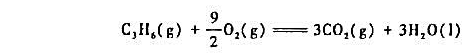
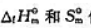 值,(1)求下列反应CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)的
值,(1)求下列反应CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)的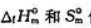 ;(2)计算上述反应在298.15K及pΘ下的ΔrGΘm值,.并判断由CO2(g)和NH3(g)反应生成尿素是否为自发过程.
;(2)计算上述反应在298.15K及pΘ下的ΔrGΘm值,.并判断由CO2(g)和NH3(g)反应生成尿素是否为自发过程.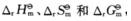 ,并说明通入O2的目的?
,并说明通入O2的目的?
















