 更多“反应的标准平衡常数等于______。已知,。”相关的问题
更多“反应的标准平衡常数等于______。已知,。”相关的问题
已知下列电极反应的标准电极电势:
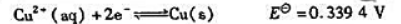
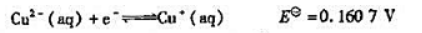
(1)计算反应: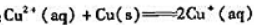 的KΘ;
的KΘ;
(2)已知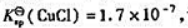 计算反应:
计算反应:
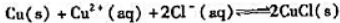 的标准平衡常数KΘ:
的标准平衡常数KΘ:
已知下列标准电极电势
Cu2++2e-===Cu EΘ=0.337V
Cu2++e-===Cu+EΘ=0.153V
(1)计算反应Cu+Cu2+===2Cu+的平衡常数。
(2)已知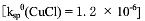 ,试计算下面反应的平衡常数。
,试计算下面反应的平衡常数。
Cu+Cu2++2Cl=2CuCl↓
计算300K时,如下反应的标准平衡常数。
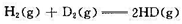
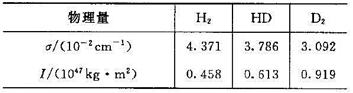
已知298 K时,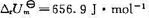 ,HD、H2、D2的有关数据如下:
,HD、H2、D2的有关数据如下:
已知可逆反应: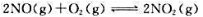 在298.15K下进时的
在298.15K下进时的 计算该可逆反应的标准平衡常数。在298.15K时,当反应系统中
计算该可逆反应的标准平衡常数。在298.15K时,当反应系统中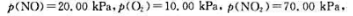 判断反应进行方向。
判断反应进行方向。
298K时,已知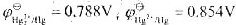 ,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
在500 ~ 1000K温度范围内,反应A(g)+B(s)=2C(g)的标准平衡常数Kθ与温度T的关系为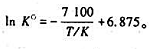 已知原料中只有反应物A(g)和过盘的B(s)。
已知原料中只有反应物A(g)和过盘的B(s)。

已知![已知向[Cu(CN)4]3-溶液中通入H2S至饱和,写出反应方程式,计算其标准平衡常数,说已知向[C](https://img2.soutiyun.com/ask/2020-11-20/974723130614456.png)
![已知向[Cu(CN)4]3-溶液中通入H2S至饱和,写出反应方程式,计算其标准平衡常数,说已知向[C](https://img2.soutiyun.com/ask/2020-11-20/974723141290067.png)
向[Cu(CN)4]3-溶液中通入H2S至饱和,写出反应方程式,计算其标准平衡常数,说明能否生成Cu2S沉淀.
已知在298K时,下列反应:
①CO2(g)+2NH3(g)===H2O(g)+CO(NH2)2(s),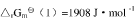
②
③C(石墨)+O2(g)===CO2(g),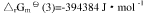
④N2(g)+3H2(g)===2NH3(g),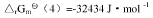 试求:(1)尿素CO(NH2)2(s)的标准摩尔生成Gibbs自由能
试求:(1)尿素CO(NH2)2(s)的标准摩尔生成Gibbs自由能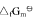 ;(2)由稳定单质生成尿素反应的平衡常数与上列反应平衡常数的关系式;(3)由单质生成尿素反应的平衡常数
;(2)由稳定单质生成尿素反应的平衡常数与上列反应平衡常数的关系式;(3)由单质生成尿素反应的平衡常数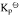 。
。
A.电对Fe3+/Fe2+做正极
B.反应Fe+2Fe3+=3Fe2+的平衡常数大约为8×1040
C.电池组成式为(-)Fe|Fe2+(c1)||Fe2+(c2),Fe3+(c3)|Pt()
D.电池的标准电动势为0.331V

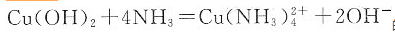 的标准平衡常数等于______。已知
的标准平衡常数等于______。已知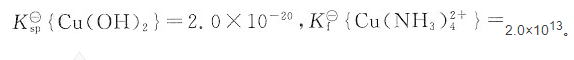 。
。
 如果结果不匹配,请
如果结果不匹配,请 

















