 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
求下列电池的电动势,并写出该电池放电时的反应方程式(浓度电位:mol·dm-3,压力单位:101.
求下列电池的电动势,并写出该电池放电时的反应方程式(浓度电位:mol·dm-3,压力单位:101.
325kPa).
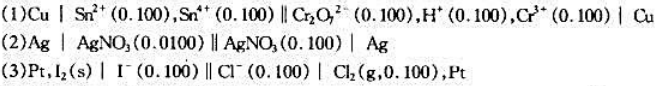
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
325kPa).
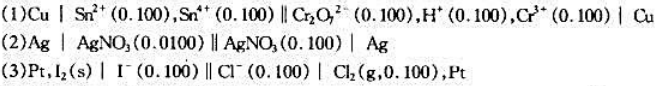
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“求下列电池的电动势,并写出该电池放电时的反应方程式(浓度电位…”相关的问题
更多“求下列电池的电动势,并写出该电池放电时的反应方程式(浓度电位…”相关的问题
有如下两个电池:
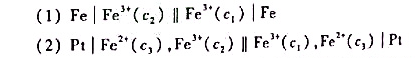
测得其电动势分别为E(1)和E(2),试求E(1)与E(2)之比。
A.电对Fe3+/Fe2+做正极
B.反应Fe+2Fe3+=3Fe2+的平衡常数大约为8×1040
C.电池组成式为(-)Fe|Fe2+(c1)||Fe2+(c2),Fe3+(c3)|Pt()
D.电池的标准电动势为0.331V
有如下原电池,其两极均为金属-金属离子电极:

当c(A2+)=c(B2+)时,电动势为0.78V。放电一段时间后电动势值减半,求此时的c(A2+)/c(B2+)。
250K时化学反应A+2B=2C速率和浓度的关系如下:

(1)写出反应的速率方程,并指出反应指数.
(2)求该反应的速率常数.
(3)求出当c(A)=0.010mol·L-1,c(B)=0.020mol·L-1时的反应速率.
有一含NaClO3的未知溶液,取50.0ml以