 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
电池A电动势为2V,内阻为1Ω,电池B电动势为2.5V,内阻为2.5Ω,先后用A,B作电源向同一电阻供电,电流相等,这个电阻阻值R=()。
A、0.5Ω
B、1.25Ω
B、2.5Ω
D、5Ω
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A、0.5Ω
B、1.25Ω
B、2.5Ω
D、5Ω
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“电池A电动势为2V,内阻为1Ω,电池B电动势为2.5V,内阻…”相关的问题
更多“电池A电动势为2V,内阻为1Ω,电池B电动势为2.5V,内阻…”相关的问题
A.B作电源向同一电阻供电,电流相等,这个电阻阻值R=()。答案选项
B.0.5Ω
C.1.25Ω
D.2.5Ω
E.5Ω
电池: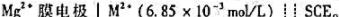 。在25℃时,测得电动势为0.387V。
。在25℃时,测得电动势为0.387V。
(1)当用未知溶液代替上述已知Mg2+溶液时。测得电池电动势为0.425V,求此溶液的pMg为多大?
(2)若溶液替代引起液接电位Ej的不稳定值为±1mV,则Mg2+浓度测定产生的相对误差有多大?波动范围为多少?
(1)写出下列各电对的电极反应式,并根据元素电势图给出各电极反应的标准电极电势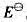 。
。
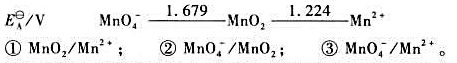
(2)试写出以电对①为负极、电对②为正极的原电池的电池反应,并计算原电池的标准电动势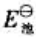 和电池反应的
和电池反应的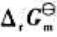 。
。
(3)试写出以电对①为负极、电对③为正极的原电池的电池反应,并计算原电池的标准电动势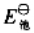 和电池反应的
和电池反应的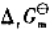 。
。
A.电对Fe3+/Fe2+做正极
B.反应Fe+2Fe3+=3Fe2+的平衡常数大约为8×1040
C.电池组成式为(-)Fe|Fe2+(c1)||Fe2+(c2),Fe3+(c3)|Pt()
D.电池的标准电动势为0.331V
下列电池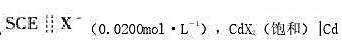 的电动势为-1.007V。计算CdX2的溶度积常数(不考虑液接电位,温度为25℃)。
的电动势为-1.007V。计算CdX2的溶度积常数(不考虑液接电位,温度为25℃)。
已知298K时下述电池的电动势为1.362V,
(Pt)H2(pθ)|H2SO4(aq)|Au2O3=Au(s)
又知H2O(g)的ΔrGmθ=-228.6kJ·mol-1,该温度下水的饱和蒸汽压为3167Pa,
求在298K时氧气的逸度为多少才能使Au2O3与Au呈平衡?
有如下两个电池:
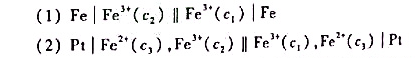
测得其电动势分别为E(1)和E(2),试求E(1)与E(2)之比。
IZn)=-0.7620V.E-[CI-IAgCl(s)IAgI=0.2222V.电池电动势的温度系数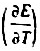 =-4.02x10-4V·K-1.
=-4.02x10-4V·K-1.
(1)写出电池反应;
(2)计算反应的标准平衡常数Kθ;
(3)计算电池反应可逆热Qr,m;
(4)求溶液中ZnCl2的平均离子活度因子ya.
已知下列原电池:
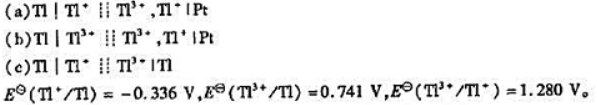
(1)写出各电池反应,并分别指出反应方程式中转移的电子数z;
(2)计算各电池的标准电动势EθMP;
(3)计算各电池反应的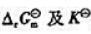 .
.