 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
对于反应CaCO3(s)=Ca2+(aq)+CO32-(aq),已知KspΘ(CaCO3)=2.8×10-9,则此温度下CaCO3的溶解度为()。
A.5.29×10-4mol/L
B.5.29×10-5mol/L
C.1.67×10-5mol/L
D.1.67×10-4mol/L
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.5.29×10-4mol/L
B.5.29×10-5mol/L
C.1.67×10-5mol/L
D.1.67×10-4mol/L
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“对于反应CaCO3(s)=Ca2+(aq)+CO32-(aq…”相关的问题
更多“对于反应CaCO3(s)=Ca2+(aq)+CO32-(aq…”相关的问题
考虑(a)在高温下由碳酸盐制备偏硅酸盐的反应,(b)在水溶液中从偏硅酸盐制备SiO2.nH2O的反应: (a)nCaCO3(s)+nSiO2(s)→[CaSiO3]a(s)+nCO2(g) (b)Na2SiO3(aq)+CO2(g)→SiO2.nH2O(s)+Na2CO3(aq) 指出每个反应中SiO2和CO2谁的酸性较强。
反应CaCO3(s)——CaO(s)+CO2(g)在973K时 =2.92×10,900℃时 =1.04,试由此计算该反应的
=2.92×10,900℃时 =1.04,试由此计算该反应的 .
.
KCl(s)298.15K时的溶解过程: KCl(s)==K+(aq,ao)+Cl-(aq,∞)△Hm=17.1810/mol已知Cl-(aq,∞)和KCl(s)的摩尔生成焓分别为一167.4410/mol和一435.87kJ/mol,求K+(aq,∞)的摩尔生成焓。
14.Write the notation for a cell in which the electrode reactions are
2H+(aq)+2e→H2(g)
Zn(s)→Zn2+(aq)+2e
根据教材附表一中的相关数据主考虑电势图N2-HN4+,(aq)-NH;(aq)在酸性溶液中Eθ(N2/HN3)和Eθ(HN3/NH4+).写出HN3(aq)的岐化反应方程,计算25℃下该反应的标准平衡常数Kθ并评价NH3(aq)的稳定性.
一定温度下,反应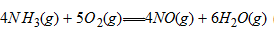 处于平衡态,若将CaO加倍,下列叙述正确的是
处于平衡态,若将CaO加倍,下列叙述正确的是
(A) 反应商加倍 (B) 反应商减半 (C) CaCO3量增加 (D) P(CO2)不变
已知298K时下述电池的电动势为1.362V,
(Pt)H2(pθ)|H2SO4(aq)|Au2O3=Au(s)
又知H2O(g)的ΔrGmθ=-228.6kJ·mol-1,该温度下水的饱和蒸汽压为3167Pa,
求在298K时氧气的逸度为多少才能使Au2O3与Au呈平衡?