 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
反应的反应方向为已知 (A) 正 (B) 逆 (C) 不反应 (D) 平衡
反应 的反应方向为已知
的反应方向为已知
(A) 正 (B) 逆 (C) 不反应 (D) 平衡
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
反应 的反应方向为已知
的反应方向为已知
(A) 正 (B) 逆 (C) 不反应 (D) 平衡
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“反应的反应方向为已知 (A) 正 (B) 逆 (C) 不反应…”相关的问题
更多“反应的反应方向为已知 (A) 正 (B) 逆 (C) 不反应…”相关的问题
A.0.24V,正向
B.0.24V,逆向
C.1.30V,正向
D.-1.30V逆向
A.向正方向进行
B.向反方向进行
C.达到平衡
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
A.任一电化学反应均发生在电子导体(或狭义上说的电极)与离子导体间的界面上
B.同一电化学反应均存在正向、逆向两个反应方向
C.正向反应的绝对速度与逆向反应的绝对速度均为正值
D.电化学反应的净速度为正、逆向反应的绝对速度的代数和
A.平衡向正反应方向移动
B.a>b+c
C.物质B的质量分数增大
D.以上判断都错误
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
已知下列元素电势图:
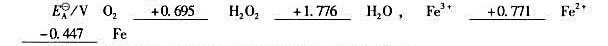
①H202能否发生歧化反应?如果能发生,写出反应式。
②在pH=3的条件下,判断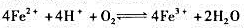 进行的方向。(设其他各离子浓度为1.0mol/L)。
进行的方向。(设其他各离子浓度为1.0mol/L)。
③计算298K时,反应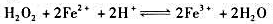 的平衡常数。(用
的平衡常数。(用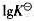 表示)
表示)
A.x+y<z
B.平衡向正反应方向移动
C.的转化率增大
D.的体积分数下降