 更多“能斯特方程式中电极电位与溶液中离子活度有一定的关系,在一定条…”相关的问题
更多“能斯特方程式中电极电位与溶液中离子活度有一定的关系,在一定条…”相关的问题
第2题
在含有Ag+、Ag(NH3)+和Ag(NH3)2+的溶液中,用银离子选择性电极采用直接电位法测得的活度是( )。
在含有Ag+、Ag(NH3)+和Ag(NH3)2+的溶液中,用银离子选择性电极采用直接电位法测得的活度是()。
点击查看答案
A.Ag+
B.Ag(NH3)+
C.Ag(NH3)2+
D.Ag++Ag(NH3)++Ag(NH3)2+
第3题
直接电位法中,加入TISAB的目的是()。A.提高溶液酸度B.保持电极电位恒定C.固定溶液中离子强度和消
直接电位法中,加入TISAB的目的是()。
A.提高溶液酸度
B.保持电极电位恒定
C.固定溶液中离子强度和消除共存离子干扰
D.与被测离子形成配位物
第4题
有一含NaClO3的未知溶液,取50.0ml以离子电极测定,当把1.00×10-2mol/L的NaClO3溶液加入被测试液中的体积分别
有一含NaClO3的未知溶液,取50.0ml以
第5题
计算pH=10.0,CNH3=0.1mol·L-1Zn2+/Zn的溶液中电对的条件电极电位(忽略离子强
计算pH=10.0,CNH3=0.1mol·L-1Zn2+/Zn的溶液中电对的条件电极电位(忽略离子强
点击查看答案
度的影响).已知锌氨配离子的各级累积稳定常数为: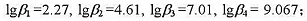 NH4+的离解常数为Ka=10-9.25.
NH4+的离解常数为Ka=10-9.25.
第6题
梅斯纳-邱西克法理论上可以计算由几种不同阳离子和几种不同阴离子组成的电解质溶液,但必须知道()的平均活度系数。
A.相应电解质物种在1mol/kg的离子强度下于纯溶液中
B.相应电解质物种在混合电解质溶液中自身所产生的离子强度下于纯溶液中
C.相应电解质物种在与混合电解质溶液总离子强度同等的离子强度下于纯溶液中
D.标准压力和298K温度下于纯溶液中
第10题
写出下列反应的离子方程式。(1)锌与氢氧化钠的反应(2)铜与稀硝酸的反应(3)高锰酸钾在酸性溶液中与亚硫酸钠反应(4)铝和盐酸的反应
写出下列反应的离子方程式。(1)锌与氢氧化钠的反应(2)铜与稀硝酸的反应(3)高锰酸钾在酸性溶液中与亚硫酸钠反应(4)铝和盐酸的反应
点击查看答案
第11题
溶液中含有活度均为1.00的Zn2+和Fe2+.已知H2在Fe上析出的过电势为0.40V,如果要使离子析出的次序为Fe、H2、Zn,问25℃时溶液的pH值最大不得超过多少?在此最大pH的溶液中,H+开始放电时Fe2+浓度为多少?


 如果结果不匹配,请
如果结果不匹配,请 

















