 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知①C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH1=-Q1 kJ·mol-1;②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1;③H2O(g)=H2O(l) ΔH3=-Q3 kJ·mol-1;若使23 g液体酒精完全燃烧,恢复到室温,则放出的热量(kJ)为()
A.Q1+Q2+Q3
B.0.5Q1-0.5Q2+1.5Q3
C.0.5(Q1+Q2+Q3)
D.0.5Q1-1.5Q2+0.5Q3
 答案
答案
B、0.5Q1-0.5Q2+1.5Q3
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案

 更多“已知①C2H5OH(g)+3O2(g)===2CO2(g)+…”相关的问题
更多“已知①C2H5OH(g)+3O2(g)===2CO2(g)+…”相关的问题
 或
或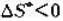 :
:
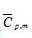 。
。 ,
,
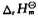 (298K)=-571.70kJ·mol-1
(298K)=-571.70kJ·mol-1
















