 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知25℃时,jθ(Cl2/Cl-)=1.35827V,jθ(Br2/Br-)=1.065V,jθ(I2/I-)=0.5345V,则还原性由强到弱排列的顺序是()
A..Cl->Br->I-
B.Cl->I->Br-
C.Br->I->Cl-
D.I->Br->Cl-
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A..Cl->Br->I-
B.Cl->I->Br-
C.Br->I->Cl-
D.I->Br->Cl-
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知25℃时,jθ(Cl2/Cl-)=1.35827V,jθ…”相关的问题
更多“已知25℃时,jθ(Cl2/Cl-)=1.35827V,jθ…”相关的问题
A.1.48
B.42
C.1.30
D.1.24
已知:jθ(Fe3+/Fe2+)=0.771V,jθ(MnO2/Mn2+)=1.23V,jθ(MnO4-/Mn2+)=1.4919V,jθ(Sn4+/Sn2+)=0.15V,jθ(I2/I)-=0.5345V,jθ(Cl2/Cl-)=1.3595V,jθ(Br2/Br-)=1.0652V,今有一含有Cl-,Br·,I-三种离子的混合溶液,欲使I-氧化为I2而不欲使Br-,Cl-氧化,应选下列物质中的哪种物质作为氧化剂比较合适()
A.Fe2(SO4)3
B.SnCl4
C.KMnO4
D.MnO2
由标准钴电极(Co2+/Co)与标准氯电极组成原电池,测得其电动势为1.64V,此时钴电极为负极。已知 (Cl2/Cl-)=1.36V。问:(1) 标准钴电极的电极电势为多少(不查表)?(2) 此电池反应的方向如何?(3) 当氯气的压力增大或减小时,原电池的电动势将发生怎样的变化?(4) 当Co2+的浓度降低到0.010mol·dm-3时,原电池的电动势将发生怎样的变化?数值是多少?
(Cl2/Cl-)=1.36V。问:(1) 标准钴电极的电极电势为多少(不查表)?(2) 此电池反应的方向如何?(3) 当氯气的压力增大或减小时,原电池的电动势将发生怎样的变化?(4) 当Co2+的浓度降低到0.010mol·dm-3时,原电池的电动势将发生怎样的变化?数值是多少?
已知原电池:
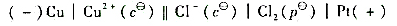
的电动势为 。
。
(1)试求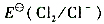 ;
;
(2)若正极Cl2的压力为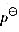 ,Cl-离子的初始浓度为0.10moldm-3,负极Cu2+离子的初始浓度为0.010mol·dm-3,试求原电池的电动势E池。
,Cl-离子的初始浓度为0.10moldm-3,负极Cu2+离子的初始浓度为0.010mol·dm-3,试求原电池的电动势E池。
B.标准状态下,MnO4-的氧化性比Cl2强,因为在电极反应中MnO4-得到的电子多
C.已知电极反应Cl2+2e-→2Cl-的φθ=1.36V,则电极反应1/2Cl2+e-→Cl-的φθ=0.68V
D.CrO42-和Cr2O72-两离子中Cr的氧化值相等
已知φΘ(Fe2+/Fe)=-0.44V,φΘ(Fe3+/Fe2+)=0.77V,φΘ(Cl2/Cl-)=1.36V,φΘ(S/H2S)=0.14V。上述电对中氧化态物质的氧化能力由弱到强的顺序正确的是()。
A.Cl2,Fe3+,S,Fe2+
B.Cl2,Fe2+,S,Fe3+
C.Fe2+,S,Fe3+,Cl2
D.Cl-,Fe2+,S2-,Fe
A.0.799
B.0.2
C.0.375
D.0
A.0.799
B.0.360
C.0.675
D.0.858
A.配体是Cl-和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中Cl-的数目比是1∶2
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀