 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
若溶液的浓度都为0.1mol.L—1,则下列水溶液的凝固点由高到低排列,顺序正确的是()。A.Na2SO4,H
若溶液的浓度都为0.1mol.L—1,则下列水溶液的凝固点由高到低排列,顺序正确的是()。
A.Na2SO4,HAc,NaCl
B.Na2SO4,NaCl,HAc
C.HAc,NaCl,Na2SO4
D.NaCl,HAc,Na2SO4
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
若溶液的浓度都为0.1mol.L—1,则下列水溶液的凝固点由高到低排列,顺序正确的是()。
A.Na2SO4,HAc,NaCl
B.Na2SO4,NaCl,HAc
C.HAc,NaCl,Na2SO4
D.NaCl,HAc,Na2SO4
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“若溶液的浓度都为0.1mol.L—1,则下列水溶液的凝固点由…”相关的问题
更多“若溶液的浓度都为0.1mol.L—1,则下列水溶液的凝固点由…”相关的问题
在298 K时,测定乙酸乙酯皂化反应速率。反应开始时,溶液中酯和碱的浓度都为0.01mol·dm-3,每隔一定时间,用标准酸溶液滴定其中的碱含量,实验所得结果如下:

(1)证明该反应为二级反应,并求出速率常数k值;
(2)若酯和碱的起始浓度都为0.002mol·dm-3,试计算该反应完成95%时所需的时间及该反应的半衰期。
电池: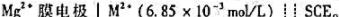 。在25℃时,测得电动势为0.387V。
。在25℃时,测得电动势为0.387V。
(1)当用未知溶液代替上述已知Mg2+溶液时。测得电池电动势为0.425V,求此溶液的pMg为多大?
(2)若溶液替代引起液接电位Ej的不稳定值为±1mV,则Mg2+浓度测定产生的相对误差有多大?波动范围为多少?
A.与NaOH反应的氯气一定为0.6 mol
B.n(Na+)∶n(Cl-) 可能为7:3
C.若反应中转移的电子为n mol,则0.3 n 0.5
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
现有M、N两种气态化合物,其摩尔质量之比为2∶1,试回答下列问题:①同温同压下,M、N气体的密度之比为()。②相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度等,则两个容器中的压强之比为()。③将M、N两种气体分别溶于水(M、N与水均不反应)配成溶液,当两种溶液的质量分数相同时,其密度分别为d1和d2,则两种溶液的物质的量浓度之比为()。
证明:
(1) 若F1,F2为闭集,则F1∪F2与F1∩F2都为闭集;
(2) 若E1,E2为开集,则E1∪E2与E1∩E2都为开集;
(3) 若F为闭集,E为开集,则F\E为闭集,E\F为开集.
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率通常用单位时间内任何一种反应物浓度的增加或生成物浓度的减少来表示
C.若某化学反应的反应速率为0.5mol·(L·S)-1就是指在该时间内反应物和生成物的浓度变化都为0.5 mol·L-1
D.化学反应速率用于衡量化学反应进行的快慢
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C2H5Br
C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60℃,可缩短反应达到平衡的时间
十二水合硫酸铝钾[KAI(SO4)2・12H2O]俗名明矾,在生活、医药、工业上应用广泛。下面是实脸室探究从铝土矿(主要成分是氧化铝,含少量氧化铁和二氧化硅杂质)制备明矾的流程示意图。![十二水合硫酸铝钾[KAI(SO4)2・12H2O]俗名明矾,在生活、医药、工业上应用广泛。下面是实脸](https://img2.soutiyun.com/shangxueba/askkp/2022-12/22/484/20221222202922290.png) 已知:二氧化硅不溶于水,也不与硫酸反应。
已知:二氧化硅不溶于水,也不与硫酸反应。
(1)铝元素在地壳中以()态存在,写出KAl(SO4)·12H2O溶于水的电离方程式()。当明矾溶液中混有NaCl时,简述如何检验Cl()。
(2)滤渣1主要为()(填化学式);以Al2O3为原料,制备该单质铝的反应方程式()。
(3)若A为金属单质,则滤渣2的成分有()。
(4)操作1是蒸发溶剂至有大量晶膜、冷却结晶。实验室进行该操作时,需要的实验仪器有铁架台、()。
(5)如图为某硫酸试剂瓶的标签。若用其配制100mL3mol/L的溶液,需该硫酸()mL(含ρ的表达式)。若此硫酸物质的量浓度为c1,35%的硫酸物质的浓度为c2,则c1()2c2(填大于,小于或等于)。![十二水合硫酸铝钾[KAI(SO4)2・12H2O]俗名明矾,在生活、医药、工业上应用广泛。下面是实脸](https://img2.soutiyun.com/shangxueba/askkp/2022-12/22/752/20221222202902517.png) (6)工业生产中,获取明矾晶体后的母液应该()(填序号)。
(6)工业生产中,获取明矾晶体后的母液应该()(填序号)。
A、弃去
B、返回酸浸流程重复利用
C、返回滤液1重复利用
D、返回滤液2重复利用