 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
298K时,已知NaOH、NaCl和NH4Cl溶液无限稀释时的摩尔电导率分别为248.41×10-4S.m2/mol、126.4×10-4S
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“298K时,已知NaOH、NaCl和NH4Cl溶液无限稀释时…”相关的问题
更多“298K时,已知NaOH、NaCl和NH4Cl溶液无限稀释时…”相关的问题
①2NH₃(g)→N₂(g)+3H₂(g)rHmΘ=92.2kJ·mol—1
②H₂(g)+ 1/2O₂(g)→H₂O(g)rHmΘ=-241.8 kJ·mol-1
③4NH₃(g)+5O₂(g)→4NO(g)+6H₂O(g)rHmΘ=-905。6 kJ·mol-1
试确定fHmΘ(NH₃,g,298K)=()kJ·mol-1;fHmΘ(H₂O,g,298K)=()kJ·mol—1;fHmΘ(NO,g,298K)=()kJ·mol—1。由NH₃(g)生产1.00kgNO(g)则放出热量为()kJ。
298K时,在某电导池内盛以浓度为0.01mol·dm-3的KCl水溶液,测得电阻R为484.0Ω。当盛以不同浓度的NaCl水溶液时测得数据如下:
| c(NaCl)/(mol·dm-3) | 0.0005 | 0.0010 | 0.0020 | 0.0050 |
| R/Ω | 10910 | 5494 | 2772 | 1128.9 |
已知298K时,0.01mol·dm-3的KCl水溶液的电导率κ(KCl)=0.1412S·m-1,试求: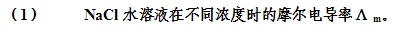

已知25℃时水的离子积常数Kw=1.008×10-14,NaOH、HCl和NaCl的摩尔电导率分别为247.8、426.16和126.45 s·cm2·mol-1。求25℃时水的电导率。
298K时,用0.1000mol/LNaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液PH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0),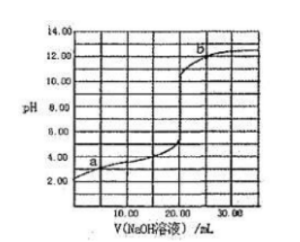 下列有关叙述正确的是()。
下列有关叙述正确的是()。
A.该滴定过程应该选择甲基橙作为指示剂
B.图中a,b两点水的电离程度:b>a
C.当加入10.00mLNaOH溶液时,c(HCOO-)>c(H+)>c(Na+)>c (OH-)
D.当加入20.00mLNaOH溶液时,溶液pH>8.0
A.①→③→④→②
B.①→③→②→④
C.①→②→③→④
D.①→④→②→③
按下列三种要求,分别计算0.020mol·kg-1的NaCl溶液在298K时的渗透压各是多少?将计算值与实验值(85kPa时)进行比较。
(1)NaCl完全解离,离子浓度按0.040mol·kg-1计算;
(2)利用式
(3)利用式
已知下述反应298K时的热效应:
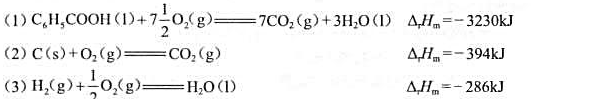 求C6H5COOH(1)的标准生成热ΔHƟm。
求C6H5COOH(1)的标准生成热ΔHƟm。
298K时,已知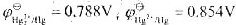 ,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
A.20℃时:NaCl不饱和溶液的质量分数、NaCl饱和溶液的质量分数
B.20℃时KNO3的溶解度、70℃时KNO3的溶解度
C.20g镁与足量盐酸反应生成H2的质量、20g铝与足量盐酸反应生成H2的质量
D.常温下,等质量的NaOH和NH4NO3固体分别溶于等量水后溶液的温度