 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
计算在非标准状态下进行氧化还原反应的平衡常数,必须先算出非标准电动势。()
计算在非标准状态下进行氧化还原反应的平衡常数,必须先算出非标准电动势。( )
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算在非标准状态下进行氧化还原反应的平衡常数,必须先算出非标准电动势。( )
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算在非标准状态下进行氧化还原反应的平衡常数,必须先算出非标…”相关的问题
更多“计算在非标准状态下进行氧化还原反应的平衡常数,必须先算出非标…”相关的问题
A.Sn4+
B.Fe3+
C.Cr3+
D.Sn2+
固体氨的摩尔熔化焓变摩尔熔化熵变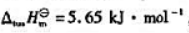 摩尔熔化熵变
摩尔熔化熵变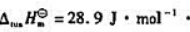 K=-1.
K=-1.
(1)计算在170K下氨熔化的标准摩尔Gibbe函数;
(2)在170K标准状态下,氨熔化是自发的吗?
(3)在标准压力下,固体氨与液体氨达到平衡时的温度是什么?
计算在1mol·L-1H2SO4介质中,用KMnO4滴定Fe2+的条件平衡常数及化学计量点的反应进行程度。(已知:MnO 4- /Mn 2+电极电位=1.45V,Fe 3+ /Fe 2+电极电位=0.68V)