 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
20mL未知浓度的弱酸HA溶液,稀释至100.0mL,以0.1mol·L-1NaOH溶液进行电势测定,用的是饱和甘汞电极-氨电极对.当一·半酸被中和时,电动势读数为0.524V,滴定终点时是0.749V,已知饱和甘汞电极的电势为0.2438V,求:(1)该酸的商解常数.(2)终点时溶液的pH.(3)终点时消耗NaOH溶液的体积.(4)弱酸HA的原始浓度.
20mL未知浓度的弱酸HA溶液,稀释至100.0mL,以0.1mol·L-1NaOH溶液进行电势测定,用的是饱和甘汞电极-氨电极对.当一·半酸被中和时,电动势读数为0.524V,滴定终点时是0.749V,已知饱和甘汞电极的电势为0.2438V,求:(1)该酸的商解常数.(2)终点时溶液的pH.(3)终点时消耗NaOH溶液的体积.(4)弱酸HA的原始浓度.
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“20mL未知浓度的弱酸HA溶液,稀释至100.0mL,以0.…”相关的问题
更多“20mL未知浓度的弱酸HA溶液,稀释至100.0mL,以0.…”相关的问题
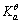 。
。
















