 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[单选题]
已知BaSO4的溶度积Ksp=1.1×10-16,将0.1mol/L的BaCl2溶液和0.01mol/L的H2SO4溶液等体积混合,则溶液()。
A.无沉淀析出
B.有沉淀析出
C.析出沉淀后又溶解
D.不一定
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.无沉淀析出
B.有沉淀析出
C.析出沉淀后又溶解
D.不一定
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知BaSO4的溶度积Ksp=1.1×10-16,将0.1m…”相关的问题
更多“已知BaSO4的溶度积Ksp=1.1×10-16,将0.1m…”相关的问题
已知KspΘ(BaSO4)=1.1×10—10,KspΘ(BaC03)=2.6×10—9,下列说法不正确的是()。
A.BaSO4不能转化为BaCO3
B.BaCO3可以转化为BaSO4
C.BaSO4可以转化为BaCO3
D.BaSO4与BaCO3可以相互转化
A.4.24×10-10mol/L
B.4.24×10-5mol/L
C.4.24×10-10mol/L
D.1.34×10-5mol/L
已知25°C时AgCl(s).水溶液中Ag+,CI-的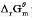 分别为-109.789kJ/mol,77.107kJ/mol和-131.22kJ/mol.求25°C下AgCl(s)在水溶液中的标准溶度积K及溶解度s。
分别为-109.789kJ/mol,77.107kJ/mol和-131.22kJ/mol.求25°C下AgCl(s)在水溶液中的标准溶度积K及溶解度s。
298.15K时,Mg(OH)2的标准溶度积常数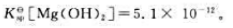 试计算:
试计算:
(1)Mg(OH)2在水中的溶解度:
(2)Mg(OH)2饱和溶液中的Mg2+、OH-的浓度和溶液的pH;
(3)Mg(OH)2在0.010mol·L-1NaOH溶液中的溶解度;
(4)Mg(OH)2在0.010mol·L-1MgCl2溶液中的溶解度。
下列电池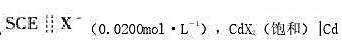 的电动势为-1.007V。计算CdX2的溶度积常数(不考虑液接电位,温度为25℃)。
的电动势为-1.007V。计算CdX2的溶度积常数(不考虑液接电位,温度为25℃)。